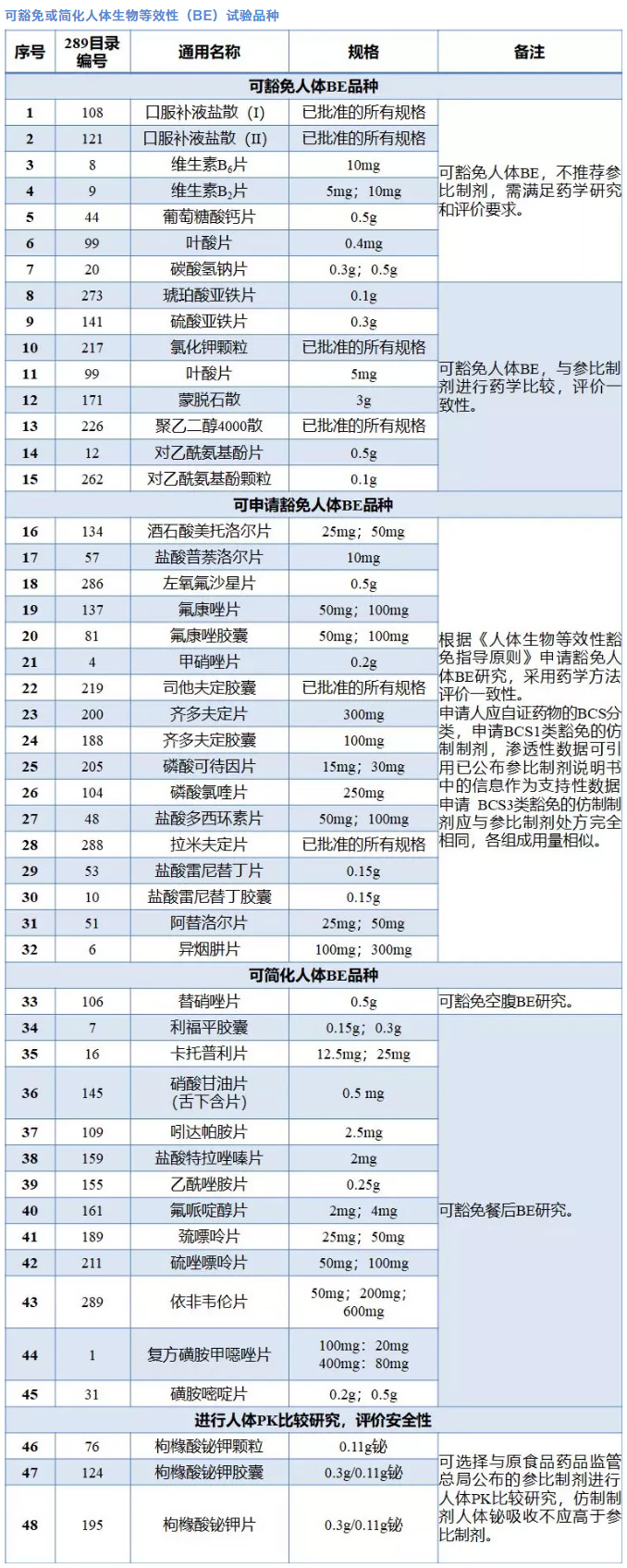
5月31日,为落实《关于仿制药质量和疗效一致性评价工作有关事项的公告》(国家食品药品监督管总局公告2017年第100号)要求,国家药品监督管理局正式发布《可豁免或简化人体生物等效性(BE)试验品种的通告(2018年第32号)》,确定了2018年底前需完成仿制药一致性评价品种目录中可豁免或简化人体生物等效性(BE)试验的48个品种大名单,其中,可豁免人体BE品种15个,可申请豁免人体BE品种17个,可简化人体BE品种(包括可豁免空腹BE和可豁免餐后BE)13个,进行人体PK比较研究评价安全性品种3个。
并非放宽标准
自2016年4月CFDA公开征求《人体生物等效性试验豁免指导原则》的意见到同年5月正式稿发布起,医药行业一直翘首期盼《可豁免或简化人体生物等效性试验(BE)品种目录》的发布。
按照《人体生物等效性试验豁免指导原则》,药品被分为四类,包括:“高溶解性、高渗透性”的BCS1类,“低溶解性、高渗透性”的BCS2类,“高溶解性、低渗透性” BCS3类和“低溶解性、低渗透性” BCS4类。其中1类和3类药物,只要处方中其他辅料成分不显著影响API吸收,则不必证明该药物在体内生物利用度和生物等效的可能性。
业内专家对记者表示,BCS1类药物需要证明药物具有高溶解性和高渗透性,才能够获得生物等效性豁免,仿制药和RLD必须均为快速溶出,且制剂中不含有影响主药成分吸收速率和吸收程度的任何辅料;BCS3类的药物则需要证明药物具有高溶解性,仿制药和RLD均能非常快速地溶出,且二者处方完全相同,组成成分用量相似,工艺放大、生产和上市后变更时,制剂处方也应当完全相同。
事实上,经过此前仿制药质量和疗效一致性评价办公室经调研论证和征求意见,业内对于豁免BE或简化BE绝非意味着放宽一致性评价标准已有共识。
“推荐豁免或简化BE品种是基于BCS分类原则,体现了我国一致性评价的标准与国际标准接轨,对宽治疗窗口的低风险产品合理豁免或简化符合药品本身的科学监管属性。”某企业研发部门负责人对记者表示,公司已经有品种受理一致性评价申请,就是按照BCS分类原则申请简化。
企业主动提速
去年11月11日,CDE曾发布《关于征求可豁免或简化人体生物等效性试验(BE)品种意见的通知》,共涉及57个产品,超过6000个批文,分为“豁免BE”和“简化BE”两类,其中可豁免BE品种44个;2017年12月18日,CDE再次发布通知,正式豁免了聚乙二醇4000相关产品的一致性评价临床试验。
为进一步提速仿制药一致性评价工作,目前国家局已经发布几十个一致性评价各类配套文件,并围绕参比制剂进行了全面深入的梳理,陆续公布了多批参比制剂目录,可以说自审评制改为备案制以来,产业和监管全链条的一致性评价推进速度均在明显加快。
品种方面,此次正式发布的48个品种名单,批文数量比较集中的盐酸雷尼替丁胶囊、甲硝唑片、对乙酰氨基酚片、异烟肼片、维生素B6片、维生素B2片等品种均列其中,聚乙二醇4000散、氯化钾颗粒、琥珀酸亚铁片、左氧氟沙星片等批文数量较少的品种也包括在内。
企业方面,据记者简略查询,此前确有不少一致性评价申请人按照豁免或简化BE的路径开展相关研究及申报,如:先声药业的蒙脱石散一致性评价申请已被受理;华润双鹤利民药业(济南)已经开展了替硝唑片的餐后BE研究;卡托普利片已有石药集团欧意药业申报一致性评价,常州制药厂、山东新华制药和山东罗欣药业也已经启动卡托普利空腹研究。(本文转载自米内网www.menet.com.cn)